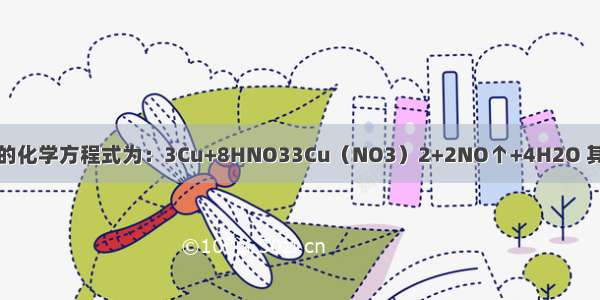
问题补充:
铜与稀硝酸可发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2↑+2NO↑+4H2O.在该反应中,作为还原产物的物质是(填化学式)________,作氧化剂的部分占参加反应的HNO3的________;若反应中生成了标准状况下的NO?2.24L,则转移电子数________;若上述反应中铜与硝酸恰好完全反应,需加含________gNaOH的溶液使铜离子全部沉淀.
答案:
NO0.3NA12
解析分析:3Cu+8HNO3(稀)=3Cu(NO3)2↑+2NO↑+4H2O中Cu元素的化合价升高,N元素的化合价降低,则硝酸被还原为NO,在该反应中8mol硝酸反应时只有2mol作氧化剂;利用化合价的变化计算转移的电子数,由2NO~3Cu~3Cu2+~6NaOH计算需要的NaOH质量.
解答:3Cu+8HNO3(稀)=3Cu(NO3)2↑+2NO↑+4H2O中Cu元素的化合价升高,N元素的化合价降低,则硝酸被还原为NO,即还原产物为NO,
在该反应中8mol硝酸反应时只有2mol作氧化剂,所以作氧化剂的部分占参加反应的HNO3的=;
若反应中生成了标准状况下的NO?2.24L,n(NO)==0.1mol,所以转移的电子数为0.1mol×(5-2)×NA=0.3NA,
由2NO~3Cu~3Cu2+~6NaOH可知,n(NaOH)=3n(NO)=×3=0.3mol,所以m(NaOH)=0.3mol×40g/mol=12g,
故
铜与稀硝酸可发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2↑+2NO↑+4H2O.在该反应中 作为还原产物的物质是(填化学式)________ 作氧化剂的部分